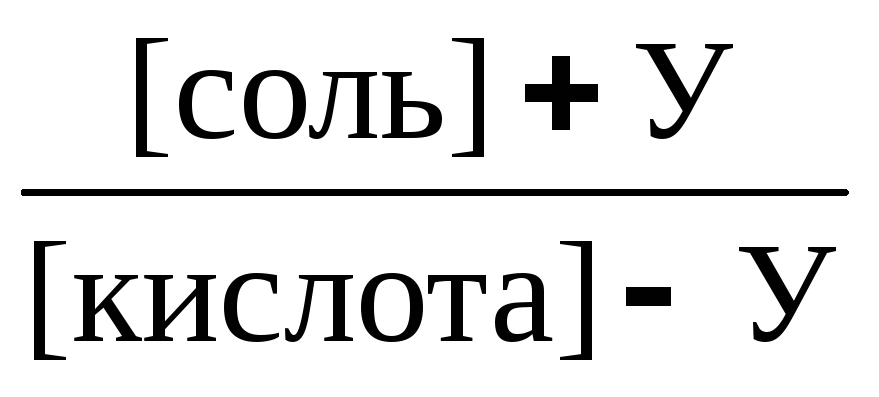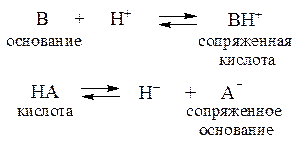pH-буферы, стандарт-титры pH (фиксаналы pH)
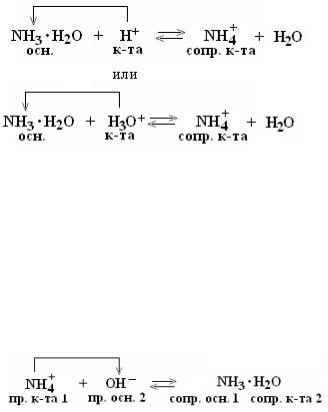
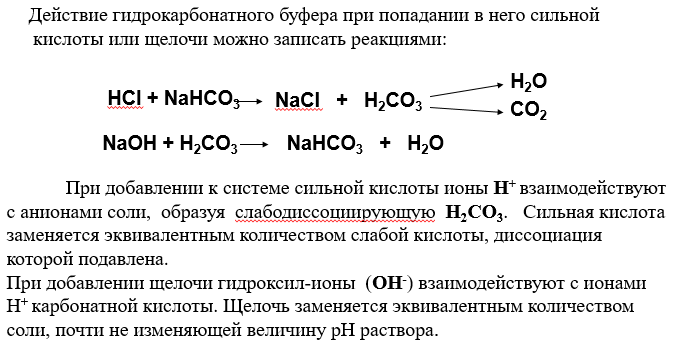
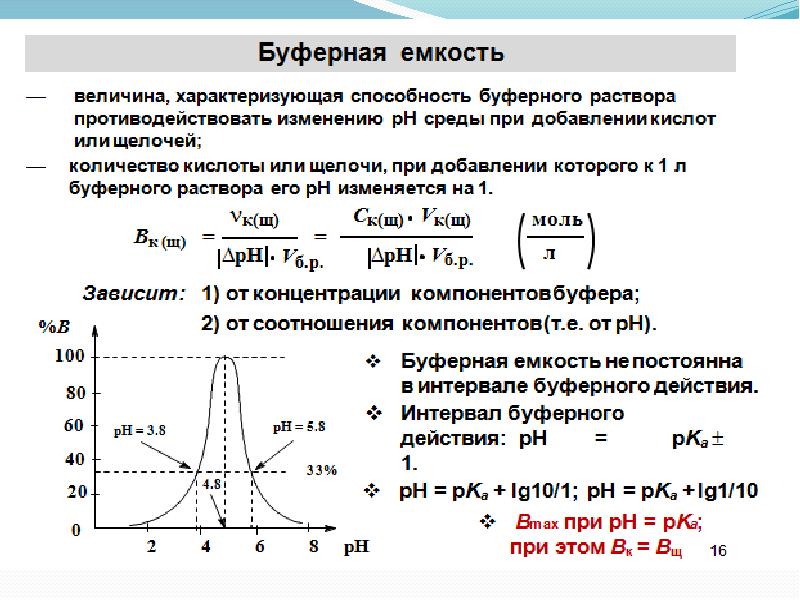
С соли. Буферное действие прекращается, как только одна из составных частей буферного раствора сопряженное основание или сопряженная кислота полностью израсходуется. Для количественной характеристики способности буферного раствора противостоять влиянию сильных кислот и оснований используется величина, называемая буферной емкостью.









Название "pH-буферы" относится к водным растворам, которые не изменяют своего значения pH, несмотря на введение небольшого количества щелочей или кислот, или при разбавлении. В практическом плане это смеси растворов слабых кислот и их солей вместе с сопряженными сильными основаниями протонодаватель-протонополучатель или, аналогично, смеси растворов слабых оснований и солей этих оснований с сильными кислотами. Основной целью использования буферных растворов является их роль в качестве агентов, позволяющих поддерживать очень стабильное значение pH. Они часто используются в широком спектре химических применений, например, при производстве красителей, во время процессов ферментации, а также для определения значения pH пищевых продуктов, косметики и фармацевтических препаратов. Основная зависимость значения pH-буфера от pK a или pK b , используемая для кислоты или основания, соответственно, а также соотношение концентраций кислоты и сопряженного с ней основания или, аналогично, основания и сопряженной с ним кислоты, описывается уравнением Хендерсона-Хассельбаха.

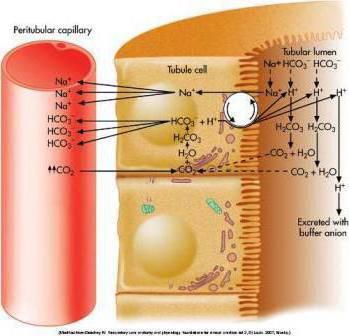

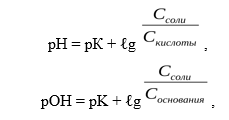


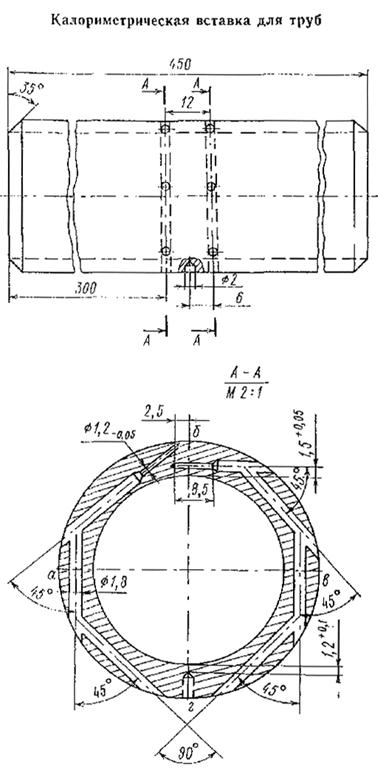
Материалы для подготовки студентов к лекциям с бионеорганической химии для студентов дистанционной формы обучения. План лекции: 1. Водородный показатель.